Неорганические соединения фосфора и их свойства
. Галогениды и оксиды фосфора
Хлорид фосфора(III) PCl3 – жидкость, кипящая при 75° С. Под действием воды полностью разлагается на HCl и фосфорную кислоту H3PO3.
Хлорид фосфора(V) PCl5 – твердое белое вещество. Получается при пропускании хлора в PCl3. Водой разлагается на HCl и фосфорную кислоту H3PO4.
Аналогичные соединения образуются с бромом, иодом и фтором, но соединение PI5 неизвестно.
Оксид фосфора(III) P2O3 (устар. фосфористый ангидрид) – белое кристаллическое вещество, плавящееся при 23,8° С. Образуется при медленном окислении или горении фосфора при ограниченном доступе кислорода. Молекулярная формула при низких температурах – P4O6. Медленно реагирует с холодной водой с образованием фосфористой кислоты H3PO3, P2O3, и H3PO3 – сильные восстановители.
Химические свойства оксида фосфора III
1. Все свойства кислотных оксидов.
P2O3 + 3H2O = 2H3PO3
2. Сильный восстановитель
O2+ P2+3O3 = P2+5O5
Фосфорный ангидрид P2+5O5 (оксид фосфора (V)).
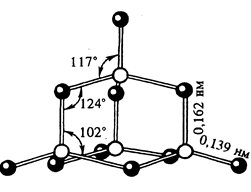
Белые кристаллы, t°пл.= 570°С, t°кип.= 600°C, r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 = 2P2O5
Химические свойства фосфорного ангидрида
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
1) P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная кислота)
2) P2O5 + 3BaO = Ba3(PO4)2
3) P2O5 + 6KOH = 2K3PO4+ 3H2O
P2O5 - сильное водоотнимающее средство:
4) P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
Фосфорные кислоты
| Формула | Название |
| HPO3 | Метафосфорная |
| H3PO2 | Фосфорноватистая (Диоксофосфорная) |
| H3PO3 | Ортофосфористая |
| H3PO4 | Ортофосфорная |
| H3PO5 | Мононадфосфорная |
| H4P2O5 | Пирофосфористая (Дифосфористая) |
| H4P2O6 | Фосфорноватная (Гексаоксодифосфорная) |
| H4P2O7 | Пирофосфорная |
| H4P2O8 | Динадфосфорная |
Свойства основных кислот
HP+5O3 Метафосфорная кислота
![]()
Получение
P2O5+ H2O = 2HPO3
Соли метафосфорной кислоты - метафосфаты (KPO3 – метафосфат калия)
Химические свойства
Характерны все свойства кислот.
H3P+5O3 Фосфористая кислота
![]()
Бесцветное кристаллическое вещество; t°пл.= 74°С, хорошо растворимое в воде.
Получение
PCl3+ 3H2O = H3PO3+ 3HCl
Химические свойства
1) Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH = Na2HPO3+ 2H2O
2) При нагревании происходит превращение в ортофосфорную кислоту и фосфин:
4H3PO3 = 3H3PO4+ PH3
3) Восстановительные свойства:
H3PO3+ HgCl2+ H2O = H3PO4+ Hg + 2HCl
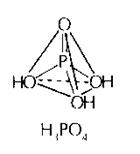 H3P+5O4 Ортофосфорная кислота
H3P+5O4 Ортофосфорная кислота
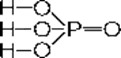
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; t°пл.= 42°С, r = 1,88 г/см3.
Диссоциация:
H3PO4 ↔ 3H+ + PO4-3
H3PO4+ 3H2O ↔ 3H3O+ + PO43-
H3PO4 ↔ H+ + H2PO4-
H2PO4- ↔ H+ + HPO42-
HPO42- ↔ H+ + PO43-
Ортофосфорная кислота - средней силы, не является окислителем, трехосновная. Она образует средние соли - ортофосфаты (Na3PO4) и два типа кислых солей - дигидрофосфаты (NaH2PO4) и гидрофосфаты (Na2HPO4). Перейти на страницу: 1 2 3
Еще статьи по теме
История природоохранной деятельности России Для человека, как и для любого другого биологического вида, природа — среда жизни и источник существования. Как биологический вид, человек своей жизнедеятельностью влияет на природную среду не больше, чем другие живые организмы. Однак ...
Международное сотрудничество в области охраны окружающей среды Неравномерность размещения природных ресурсов по территории Земли и стремление обладать тем, чего нет у себя, но есть у соседа, являлось во все времена причиной возникновения каких-либо отношений между народами (от торговли до войн ...